Bile Duct Resection/Roux-en-Y Hepaticojejunostomy 수술한 젊은 환자에서 관찰된 특발성 심실빈맥의 반복성 발생
Recurrent Occurrence of Idiopathic Ventricular Tachycardia after Extubation Undergoing Bile Duct Resection, Roux-en-Y Hepaticojejunostomy in Young Patient
Article information
Trans Abstract
Arrhythmias occurring during surgery are mostly benign and improve without special treatment, but sometimes life threatening and poor vital signs may require immediate antiarrhythmic or electrotherapy. In some cases, permanent arrhythmias may require continued treatment after surgery. A cardiac event occurred to a 28-year-old man who underwent Bile duct resection/Roux-en-Y hepaticojejunostomy due to cholelithiasis with cholecystitis and choledocholithiasis. He diagnosed mental retardation level 2. Pre-operation laboratory test is normal except liver function test (AST 64, ALT 141). Electrocardiography shows 57 bpm heart rate, sinus rhythm, first degree AV block and long corrected QT interval that was checked 462ms and echocardiography shows LVEF 67%, normal echocardiogram. When we prepared extubation after finishing operation, Sugammadex 200mg was injected. Suddenly, patient’s oxygen saturation was low at 85%. We started manual ventilation for oxygenation and saturation was increased at 100%. When we extubated endotracheal tube, his ECG changed normal sinus rhythm to idiopathic ventricular tachycardia (VT). Firstly we considered that is paroxysmal supraventricular tachycardia and infused adenosine 6mg twice and 12mg once. But arrhythmia was continuous and vital sign changed unstable. We performed reintubation and defibrillated at 200J. After defibrillation, arrhythmia converted sinus rhythm. We transferred the patient to the ICU and evaluated further to see if the patient had heart problems. During admission in ICU, attending surgeon tried to extubate endotracheal tube 2 more times. But, Idiopathic VT occurred whenever try to extubate. Finally, in the fourth attempt, extubation without occurrence of VT succeeded with continuous intravenous infusion of esmolol and dexmedetomidine.
Introduction
부정맥은 수술 중 발생할 수 있는 흔한 합병증이며 때때로 환자의 생명을 위협할 수 있는 심각한 합병증이다[1]. 수술 중 발생하는 부정맥은 대부분 양성으로 특별한 처치 없이 회복되지만 때때로 생명을 위협하고 활력징후가 나쁜 경우에는 즉각적인 항부정맥제나 심장 전기충격법이 필요할 수 있다[2]. 또한 경우에 따라서 영구적인 부정맥으로 수술이 끝난 후에도 지속적인 치료를 요구하기도 한다. 수술 중에 마주치는 다양한 상황, 환자의 기저 질환, 약물 복용력 등이 부정맥을 야기할 수 있다. 우리는 심혈관계 기저질환이 없는 젊은 환자에서 담관절제술 및 Roux-en-Y 간공장문합술(bile duct resection, Roux-en-Y hepaticojejunostomy) 수술을 마치고 환자를 깨운 뒤 기도발관을 시행할 때마다 반복적으로 특발성 심실 빈맥이 발생한 환자의 증례를 통해 원인 및 진단을 찾고 치료 및 예후에 대하여 조사하여 보고하고자 하였다.
Case Report
원위총담관협착(distal common bile duct stricture) 및 총담관결석증(choledocholithiasis)과 담석증(cholelithiasis)이 동반된 담낭염(cholecystitis)으로 28세 남자 환자(신장 156.3 cm, 체중 60.5 kg)가 울산대학교병원 소화기내과로 내원하였다. 우선 내시경적역행담췌관조영술(endoscopic retrograde cholangiopancreatography, ERCP)을 통하여 총담관결석 제거 시도하였으나 원위총담관협착으로 실패하였으며 이어서 외과로 의뢰되었으며, 담관절제술 및 Roux-en-Y 간공장문합술(bile duct resection/Roux-en-Y hepaticojejunostomy) 수술이 결정되었다.
환자는 정신지체 2급의 장애를 가지고 있는 병력 외에 특이 병력은 없었다. 수술 전 시행한 검사실 검사(laboratory test)에서는 간기능 검사(AST 64, ALT 141)의 비정상 소견 외엔 특이 소견은 없었으며, 심혈관계 검사 중 심전도 검사 결과로 심박수 57회/분의 동율동, 1도 방실 차단, 462 ms로 연장된 QT 간격 소견이 관찰되었다(Fig. 1). 심장초음파 검사에서는 67%의 좌심실구축률의 정상 심초음파 소견을 보였다. 호흡기계 검사 중 흉부 방사선 사진에선 다수 일부 무기폐 소견을 보였으며, 폐기능 검사는 환자의 정신지체 병력으로 협조가 안되어 시행 불가능하였다. 심전도와 관련하여 수술 전 시행한 심장내과 위험도 평가에선 낮은 위험도로 문제없이 수술 가능하다는 답변을 받았으며, 무기폐 소견 관련하여 시행한 호흡기내과 위험도 평가에선 보통의 위험도로 수술 가능하다는 답변을 받았다.
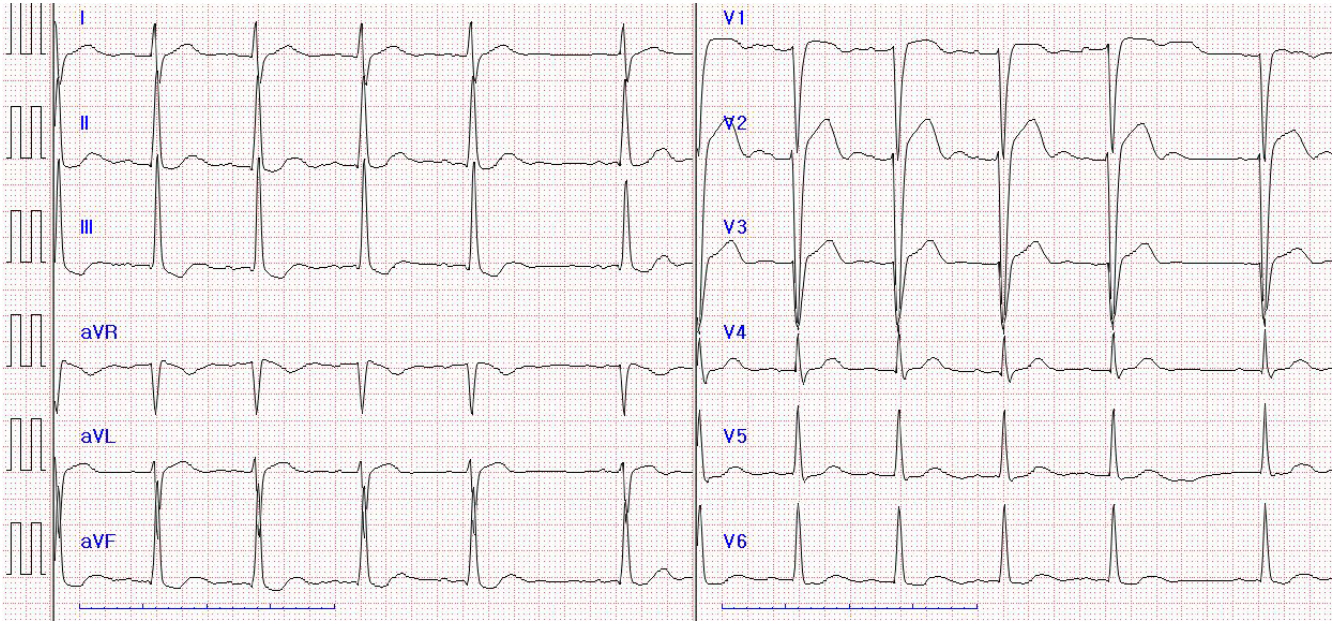
Patient's pre-operative ECG. 57 bpm heart rate, sinus rhythm, first degree AV block and long corrected QT interval that is checked 462 ms.
수술실 입실 후 V5-유도 심전도, 비침습적 혈압, 맥박 산소포화도, bispectral index score(BIS)를 적용하여 모니터 하였다. 2% 리도카인 60 mg, 1% 프로포폴 150 mg, 로큐로늄 50 mg으로 마취 유도하였고, 세보플루란 5 vol % 과 산소로 마스크 환기 후 기도삽관 하였으며 세보플루란 2 vol % 및 레미펜타닐로 마취 유지하였다. 우측 요골동맥(radial artery)에 카테터 삽입 후 수술 중 지속적으로 침습적 동맥 혈압을 관찰하였으며, 이어서 우측 내경정맥(internal jugular vein)에 3-내강 카테터로 중심관 정맥 확보 후 중심정맥압(CVP) 측정을 하였다. BIS 사용하여 마취 심도를 평가하였다.
마취 유도 완료 후 흡입산소농도 50%에서 즉시 시행한 동맥혈 가스검사 상 pH 7.55, PaCO2 25 mmHg, PaO2 262 mmHg 이었고 전해질은 Na+ 144 mmol/L, K+ 3.2 mmol/L, Ca2+ 0.92 mmol/L 이었으며 혈당 82 mg/dL, 헤모글로빈 수치는 12.9 g/dL 이었다. 수술 시작 2시간 경과 동맥혈 가스검사 상 pH 7.48, PaCO2 33 mmHg, PaO2 204 mmHg 이었고 전해질은 Na+ 141 mmol/L, K+ 3.4 mmol/L, Ca2+ 1.07 mmol/L 이었으며 혈당 100 mg/dL, 헤모글로빈 수치는 13.0 g/dL 이었다. 수술 종료 후 시행한 동맥혈 가스검사 상 pH 7.50, PaCO2 32 mmHg, PaO2 220 mmHg 이었고 전해질은 Na+ 142 mmol/L, K+ 3.1 mmol/L, Ca2+ 0.95 mmol/L 이었으며 혈당 91 mg/dL, 혈색소 농도는 10.2 g/dL 이었다. 수술 중 추정실혈량(Estimated Blood Loss)은 700 ml, 총 수술 시간은 4시간 25분, 총 마취 시간은 6시간이었다. 수술 종료 후 신경근차단(neuro-muscular blockade) 회복을 위해 슈가마덱스(Sugammadex) 200 mg 투여 후 10분 뒤 사연속반응비가 98%, BIS 수치는 92이었으며, 환자는 눈을 뜨고 자발호흡이 시작되었다. 인상을 찌푸리며, 일회 호흡량이 150–200 mL 정도로 측정되어 5분간 자발호흡을 도와주며 관찰한 뒤, 일회 호흡량이 350 mL 이상 규칙적으로 측정되는 것을 확인하고 기도발관을 시행하였으나 갑자기 환자의 맥박 산소포화도가 85%로 떨어지면서 수축기 혈압이 200 mmHg까지 상승하여 마스크 환기 시행하며 니카르디핀 500 mcg를 2회 투여하였다. 이후 심전도가 단형 심실빈맥 양상으로 변하여 리도카인 60 mg, 에스모롤 30 mg 2회, 20 mg 1회 투여하였고 이상소견 지속되어 아데노신 6 mg 2회, 12 mg 1회 투여하였으나 호전되지 않았다. 결국 숙시닐콜린 100 mg 정맥주사 후 다시 기도삽관한 뒤 200 J로 심율동전환술(cardioversion) 시행하였고 동율동으로 전환되었다. 이후 집도 의사와 상의하여 환자 안정된 후 추가 검사와 기도발관 시도하기로 결정하고 기도삽관된 상태로 외과계중환자실로 전동하였다.
외과계중환자실 전동 2시간 후 환자 의식 회복과 함께 심한 동요 상태로 혈압 상승하면서 다시 심실빈맥 소견(Fig. 2) 보여 150 J 심율동전활술을 시행하여 동율동으로 전환되었다. 이후 프로포폴 및 레미펜타닐을 지속적 투여하여 진정시켰으며 아미오다론 300 mg 으로 부하용량 투여 후 0.5 mg/min 으로 지속 투여하였다. 수술 후 1일차에 다시 한번 기도발관 시행하였으나 환자 심한 통증 호소하면서 혈압 상승하고 심실빈맥 발생하여 다시 기도삽관 후 150 J 2회의 심율동전환술을 시행한 뒤 동율동으로 회복하였다. 이후 침상에서 심초음파 시행하였고 결과는 좌심실구축률(left ventricular ejection fraction) 65%, 정상 소견이었다. 위와 관련하여 시행한 심장내과 의뢰 소견 상 환자는 심실빈맥 소견이었으나 정상 심기능 및 정상 심구조로 아미오다론 지속적 투여 권유하였으며, 아미오다론 투여 중에도 조절되지 않는다면 아미오다론 중단과 에스모롤 지속 투여를 하도록 권유하였다. 수술 후 2일차 다시 기도발관 시행하였고 환자 심한 동요 상태에서 수축기혈압이 200 mmHg 이상 상승하고 심실빈맥 재발하여 다시 기도삽관 시행하였다. 상기 상황과 관련하여 심장내과 타과 의뢰 재시행 하였으며, 기도발관 후 심한 동요 상태 혹은 호흡성 스트레스 등으로 카테콜아민 과분비로 인한 심실빈맥이 발생하였을 가능성이 가장 높다는 소견과 에스모롤 지속 투여 및 신중하고 조심스러운 기계 환기 이탈을 시도하라는 답변을 받았다.
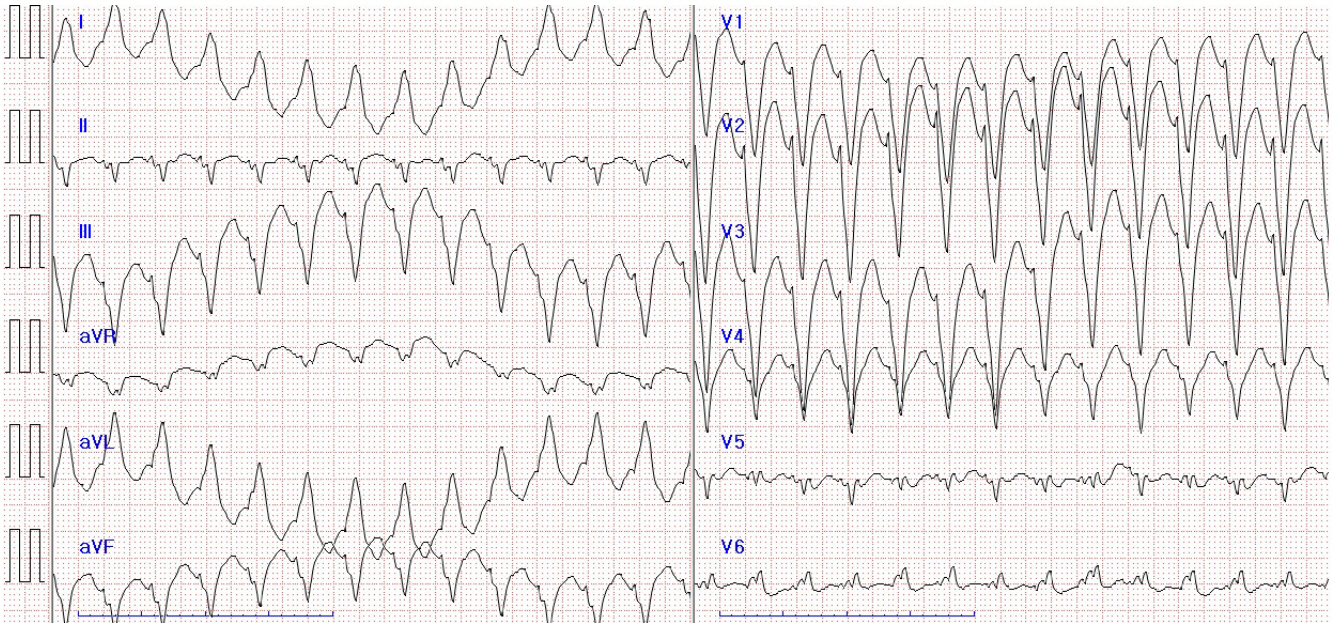
Patient's post-extubation ECG. Immediately after extubation, monomorphic ventricular tachycardia is detected.
이후 환자는 발열 및 무기폐(atelectasis) 소견이 보여 진정치료 후 항생제 투여하면서 지속하여 기계환기를 유지하였다. 수술 후 4일차부터 아미오다론 중단 후 에스모롤 10 mcg/kg/min 으로 지속투여 시작하였다. 수술 후 8일차 덱스메데토미딘 0.4 mcg/kg/min, 에스모롤 30 mcg/kg/min 상태에서 기도발관 시행하였고 심전도 상 동율동(Fig. 3) 유지되었으며, 맥박 산소포화도가 80%로 측정되어 80% 흡입산소농도의 고유량 비강 캐뉼라(high flow nasal cannula)를 적용하였다. 이후 맥박 산소포화도 93%, 호흡수 20회/분, 심박수 73회/분, 혈압 103/47 mmHg, 동맥혈 가스검사 상 pH 7.53, PaCO2 28 mmHg, PaO2 138 mmHg 이었고 전해질은 Na+ 142 mmol/L, K+ 3.0 mmol/L, Ca2+ 1.11 mmol/L 이었다. 이어서 덱스메데토미딘은 투여 중단하였고 에스모롤 20 mcg/kg/min 으로 유지하였다. 이후 환자 맥박 산소포화도는 안정적으로 유지되어 중환자실에서 경과 관찰하였으나 수 차례 구토를 하였다. 수술 후 11일차 환자 다시 열나고 산소포화도 유지되지 않아 시행한 흉부 방사선 검사 상 흡인성 폐렴(aspiration pneumonia) 의심되어 기관절개술(tracheostomy) 후 기계환기(mechanical ventilation)를 재차 시작하였다.

Post-operative day 8. After extubation with dexmedetomidine 0.4 mcg/kg/min and esmolol 30 mcg/kg/min, patient's ECG is kept as sinus rhythm.
이후 환자의 폐 상태 호전되어 수술 후 21일 기계환기이탈 후 수술 후 22일 일반 병실 전동하였으며, 수술 후 37일째 퇴원하였다. 기도발관을 시행한 후 퇴원할 때까지 심실빈맥은 더 이상 재발하지 않았고 지속적 에스모롤 투여는 수술 후 17일부터 비소프로롤 경구 제제로 대체하여 복용하였다.
Discussion
심실 빈맥은 환자의 생명을 위협하는 즉각적인 대처가 필요한 부정맥 중 하나이다. 마취 중 심실 빈맥이 발생하는 원인은 저산소혈증, 과탄산혈증, 산증, 전해질 불균형, 저혈압, 기계적 자극, 저체온, 얕은 마취에서 전기소작기 등 전기적 자극으로 인한 아드레날린성 과흥분 작용, 항부정맥제, 심근증, 관상동맥질환 등으로 인한 심근허혈과 같은 다양한 원인이 있다.
심실 빈맥을 평가할 때는 부정맥의 지속 기간, 형태, 동반된 증상, 연관된 심질환의 유무를 따져봐야 하며, 이를 통해 진단 및 예후를 예측할 수 있다. 대부분의 악성 부정맥은 저명한 심장질환이 있을 때 발생하고 이 경우 급사의 가능성이 높다. 돌연 심장사의 대부분은 심실 세동 혹은 심실 빈맥에 의해 발생하며 대략 90% 이상의 돌연 심장사에서 심장 구조에 이상이 발견된다[3]. 드물게 정상 심장을 가진 것처럼 보이는 환자에서 심실 세동 혹은 심실 빈맥이 발생하기도 한다. 하지만 이 중 대부분은 심장 이온 채널이나 구조 단백질의 교란과 같은 명확히 보이지 않는 심장 구조와 기능 이상에 의한 것으로, 이런 경우 돌연 심장사(sudden cardiac death)의 가능성이 높다. 한편 대략 10% 정도의 환자에서 심장 구조와 기능에 이상이 없이 심실 세동 혹은 심실 빈맥이 발생한다[4,5].
특발성 심실 빈맥은 정상 구조와 기능을 가진 심장에서 발생하며 양호한 예후를 보여주는 단형 심실 빈맥을 의미한다. 특발성 심실 빈맥을 진단하기 위해서는 환자의 심장에 이상이 없음을 밝히는 것이 중요하다. 심실 빈맥이 발현되지 않았을 때 심전도(electrocardiography), 심장초음파(echocardiography), 관상동맥조영술(coronary angiography)이 정상이며 심혈관자기공명영상(cardiovascular MRI)의 경우 일부 종류에서 경미한 구조적 이상이 발견되기도 하지만 심실 빈맥의 기원이 되는 위치와 일치하지 않기 때문에 이러한 변화가 유의미한지는 불명확하다[6].
특발성 심실 빈맥은 기시 부위에 따라서 우-단형 심실 빈맥과 좌-단형 심실 빈맥으로 나뉘며 70% 이상이 우측에서 기원한다. 몇몇 생리-병리학적 유형들이 부정맥의 형태, 아드레날린성 스트레스와 상관관계, 다양한 약물에 대한 반응성을 바탕으로 분류되었다[7]. 우심실 유출로 심실 빈맥(Right ventricular outflow tract tachycardia, RVOT-VT)은 좌각차단(left bundle branch block, LBBB) 형태와 하향측 성질을 띄는 넓은 QRS complex의 형태적 특징을 보이며[8], 유출로에서 기원하는 빈맥 중 90%를 차지한다. 대부분 30 ~ 40대에 진단받으며 80% 가량의 환자들이 심계항진을 느끼고 약 50% 가량의 환자들이 전-실신(pre-syncope)을 경험한다. 운동이나 감정적인 스트레스에 의해 유발되며 돌연 심장사는 드물다. 비지속적이고 반복적인 단형 심실 빈맥과 발작성/운동-유발성 지속적 심실 빈맥의 2가지 종류로 나뉘며 앞의 것이 2/3, 뒤의 것이 1/3을 차지한다. RVOT-VT은 유형에 관계없이 아데노신에 잘 반응한다.
특발성 좌심실 빈맥은 좌심실에서 기원하며 가장 흔한 것은 베라파밀 민감성 심실 빈맥이다. 20 ~ 40대에 주로 유발하며 남성에서 더 빈번하다[9]. 심전도 상 좌측 축 배열된 우각차단(RBBB) 형태이며 드물게 우측 축 배열 형태로 나타나기도 한다. 빈맥 발생 시 두근거림, 어지러움, 실신 등의 증상을 겪게 되고 돌연 심장사는 드물다. 베라파밀에 잘 반응하지만 아데노신은 효과적이지 않다. 경증의 환자에서 베라파밀의 장기 처방이 효과적이며, 증상이 심한 경우 전극도자 절제술이 효과가 좋다[9].
특발성 프로프라노롤 민감성 심실 빈맥은 50대에 발생하며 단형성 혹은 다형성의 빈맥이다. 이소프로테레놀에 의해서만 유발되며 β-차단제가 효과적이다[5].
본 증례 환자의 심실 빈맥 발생 시 심전도 형태를 보면 좌각차단이 동반된 단형 심실 빈맥의 형태로, 주로 얕은 진정 혹은 기도발관과 같은 자극적인 상황에서 유발되었고 β-차단제로 조절되었다. 이상은 특발성 심실 빈맥 중 RVOT-VT의 형태와 비슷하다. 하지만 아데노신에 반응하지 않았다.
RVOT-VT과 감별이 필요한 치명적인 질환으로 부정맥 유발성 우심실 심근병증(arrhythmogenic right ventricular cardiomyopathy, ARVC)이 있다. 이 질환은 유전성 심근병증으로 뚜렷하게 우심실에 영향을 준다. 이 질환의 주요 병리학적 특징은 우심실의 심근이 점점 손실되면서 섬유-지방 조직으로 대체되는 것이다[10]. 이것은 젊은 사람이나 운동선수에서 갑자기 발생하는 심정지의 주요 원인 중 하나이다. 이 질환은 일반 대중에서 5000명당 1명의 유병률을 보이며, 20 ~ 40대의 젊은 층에서 주로 발병하고, 급사가 첫 임상 양상으로 나타나는 경우가 많다[11]. 실제 이탈리아 Veneto 지역에서 조사한 자료에 따르면 젊은 인구나 운동선수에서 발생한 급사의 20% 가량이 진단되지 않은 ARVC에 의한 것으로 밝혀졌다[10]. 이 질환은 초기에는 우심실의 심근의 발달 상의 선천적인 결함으로 인한 이형성증으로 생각되었으나 최근에 심장 세포간 연접에(Cell to cell adhesion) 중요한 역할을 하는 데스모솜(Desmosome)의 유전적 결함이 원인임을 발견하였고 이후 미국 심장 협회에서 심근병증으로 분류하였다[12].
이 질환의 가장 흔한 증상은 심계항진 혹은 활동 유발성 실신이며 심전도에서 좌각차단이 동반된 심실성 부정맥 소견을 보인다. 심실성 부정맥은 잦은 조기심실박동부터 심실 세동으로 전환될 수 있는 심실 빈맥까지 다양하며 아드레날린성 자극에 의해 유발되거나 악화할 수 있다[11]. ARVC 환자는 치명적인 부정맥로 인하여 급사하거나 혹은 양측 심실 수축 기능의 장애로 인한 심부전으로 사망할 수 있으며, 1년 사망률은 대략 1% 정도이다[11]. ARVC 치료의 목적은 돌연 심장사를 예방하고, 부정맥 발생을 줄여 심부전 진행을 막고 삶의 질을 개선하는 것이다. 이를 위해서 부정맥을 유발할 수 있는 강도 높은 운동을 제한하고, 부정맥 및 심부전 예방을 위해 β-차단제를 투여한다. 증상 개선을 위해 아미오다론을 단독 혹은 β-차단제와 병행하여 투여하거나, 소타롤을 투여할 수 있지만 돌연 심장사를 예방하지는 못한다. 지속적 단형 심실 빈맥을 동반한 경우 전극도자 절제술을 시행할 수 있으나 재발이 빈번하여 효과적이지 않다. 돌연 심장사 예방을 위하여 고위험군에서 체내삽입형제세동기(implantable cardioverter-defibrillator, ICD)를 삽입할 수 있다. ARVC의 경우 경과가 좋지 않기 때문에 RVOT-VT과 감별하여 판단하는 것이 중요하지만 심전도 검사의 낮은 특이도와 심초음파를 통한 우심실의 구조와 기능을 평가하기 어렵고, 심장 자기공명영상의 경우 고가의 검사로 쉽게 적용하기 어려워 정확한 감별은 어렵다[11]. 심전도 상 기준 동율동에서 V1 ~ V3 T파 역위(inversion)는 흔히 관찰되지만 최근의 연구에 의하면 이 비율은 전체 ARVC 환자의 오직 32%에서만 관찰된다고 한다[13]. 한가지 형태 이상의 심실 빈맥 발현 시 ARVC를 의심할 수 있는데 이것은 ARCV가 우심실의 다양한 부위에 영향을 끼치기 때문이다. 하지만 발병 초기에는 한가지 형태의 심실 빈맥만 발현될 수 있고 특발성 심실 빈맥에서도 드물지만 다형성 심실 빈맥이 발현할 수 있어 감별에 주의가 필요하다[13]. ARVC 2010 Task Force Criteria로 진단의 정확성이 개선되었으나, 초기의 ARVC 환자와 RVOT-VT 환자를 감별하는 것은 여전히 어렵다. 심전도, 심초음파, 심장자기공명영상 등 검사 결과를 분석한 결과 초기 ARVC 환자의 심근 기능이 변한 것을 알 수 있었는데, 이러한 구조적/기능적 차이를 분석하면 초기 ARVC와 RVOT-VT을 감별하는데 도움이 된다[14].
검사결과 환자의 심장에 구조적, 기능적 이상은 없었으며, 심전도는 좌각차단이 동반된 단형 심실 빈맥 형태였고, 아데노신에는 반응하지 않았으며, 더욱이 증례에서의 심실 빈맥은 마취 회복시기의 얕은 마취 심도나 기도발관과 같은 환자를 자극시키게 되는 조건에서 반복적으로 발생하였다. 이러한 특징들의 심실 빈맥 유형은 정상 심장에서 발생하는 특발성 심실 빈맥으로 판단할 수 있었다. 특발성 심실 빈맥의 경우 순환계통의 기저질환이 없는 젊은 환자군에서 발생할 수 있다. 따라서 마취의사는 특발성 심실 빈맥의 진단과 치료에 대한 개념을 친숙하게 가지고 있어야하며, 적절한 환자 평가와 상황 판단으로 이러한 부정맥 증례 발생 시 당황하지 않고 올바르게 대처해야 한다.
Notes
Ethics approval
The study was approved by the institutional review board of Ulsan University Hospital (No. IRBUUH 2020-05-020).
Conflict of interest
All authors declare no conflicts-of-interest related to this article.