코로나바이러스감염증-19 예방접종
Coronavirus Disease 2019 Vaccine
Article information
Trans Abstract
Coronavirus disease 2019 (COVID-19) vaccination is necessary to prevent infection, morbidity, and mortality. In addition to the usual post-inoculation hypersensitivity reactions including headaches, muscle and joint pain, and fever, especially after the second shot, the mRNA vaccine has risk of inflammation in the heart and heart lining of some recipients, mostly younger people. And the adenovirus vector vaccine can induce rare immune thrombocytopenia. Vaccination should be encouraged according to the information about the effectiveness and safety in individual situation.
Introduction
코로나바이러스감염증-19(coronavirus disease 2019, COVID-19) 유행이 지속되고 있으나[1], 치료제의 효과가 제한적이어서 사회적 거리두기와 예방접종의 중요성이 강조되고 있다.
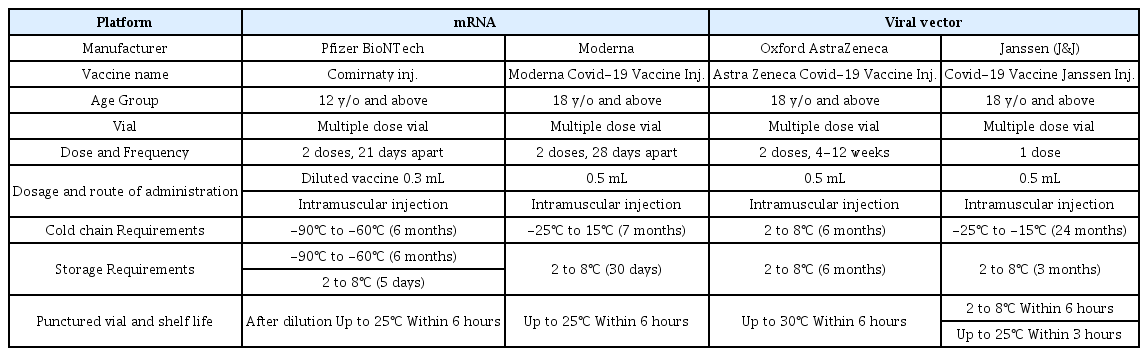
코로나19 예방접종은 영국에서 2020년 12월에 시작되었으며 국내에는 2021년 2-5월 사이에 아스트라제네카 코로나19 백신(한국아스트라제네카코비드-19백신주), 화이자 코로나19 백신(코미나티주), 얀센 코로나19 백신(코비드-19백신 얀센주), 모더나 코로나19 백신(모더나코비드-19백신주)가 허가되어 사용되고 있다(Table 1)[2]. 고령층, 기저질환이 있는 환자를 우선적으로 예방접종을 시행하였고, 최근에 와서는 임신부, 12세 이상 소아청소년에게도 접종을 시작하였기에[2] 유효성과 안전성에 대한 점검이 필요하다.
이에 우리나라에서 사용하고 있는 COVID-19 백신의 유효성과 안전성에 관한 정보와 다양한 대상군에서의 COVID-19 백신 사용에 대한 고려사항을 살펴보고자 하였다.
백신의 유효성과 안정성
백신의 유효성을 평가하는 요소 중 피접종자의 혈청 항체가 감염과 발병을 방지하는 수준에 이른 사람의 비율로 평가하는 면역원성(immunogenicity)은 효능이나 효과를 온전히 예측할 수 없으므로, 접종군과 대조군과의 발병률 차이를 비교하는 효능(efficacy)과 감염병이 실제로 얼마나 감소했는지를 평가하는 효과(effectiveness)를 확인해야한다.
1. mRNA 백신(화이자, 모더나)
접종군과 대조군과의 발병률, 중증화율, 치명률, 무증상자의 차이를 비교하는 효능은 3상 임상시험에서 화이자 백신은 95.0%(95% confidence intervals[CI] 90.3-97.6), 모더나 백신은 94.1%, 바이러스 백터 백신인 아스트라제네카 백신 70.4%이나, 얀센 백신 66.9%보다 높은 수준으로 관찰되었다[3].
감염병이 실제로 얼마나 감소했는지를 평가하는 효과는 감염 예방, 중증화 예방, 입원률 감소, 사망률 감소 등으로 평가된다. 이스라엘에서 화이자 2회 접종자 471만여명을 분석한 결과 유증상 COVID-19 예방효과는 95.3%(95% CI 94.9-95.7), 무증상 COVID-19 예방효과는 91.5%(95% CI 90.7-92.2), 입원 예방효과는 97.2%(95% CI 96.8-97.5), 사망 예방효과는 96.7%(95% CI 96.0-97.3)이었다. 미국에서 수행한 연구에서 화이자 또는 모더나 백신 1차 접종의 예방효과는 80%, 2회 접종 시 예방효과는 90%였으며, 65세 이상 대상 분석에서는 2회 접종 시 입원 예방효과가 94%다. 영국에서 수행한 연구에서는 화이자 백신 1회 접종 시 유증상 또는 무증상 COVID-19 예방효과는 70%(95% CI 55-85), 2회 접종 시 85%(95% CI 74-96)로 관찰되었다. 이스라엘에서 수행한 연구에서 화이자 1차 접종 시 효과가 접종 후 1-14일 사이에는 47%, 15-28일 사이에는 85%였다[4]. 델타형 변이에 대한 효과는 스코틀랜드 연구에서 화이자 2차 접종 시 87.9%[5], 이스라엘에서는 기존 코로나19 바이러스에 대해 94%였던 화이자 백신의 효과가 델타변이에 대해서는 64%로 낮아졌다고 보고되었다[6]. 이상반응 신고는 화이자 백신은 약 113만 접종에 이상반응 6,700여건으로 0.60%, 모더나 백신은 약 4만 접종에 이상반응 180여건으로 0.46%이었다. 주로 나타나는 이상반응은 국소반응으로 접종부위 통증, 부기, 홍반이 있었고 전신반응으로 피로감, 두통, 근육통, 오한, 관절통, 발열, 메스꺼움 등이 있었다. 심각한 이상반응으로mRNA 코로나19 백신 접종 후 심근염(myocarditis)∙심낭염(pericarditis)이 드물게 보고되었다[2]. 주로 12-29세 남성에서 발생하고, 1차보다 2차 접종 후 더 많이 발생했다. 일반적으로 백신 접종 후 수일 이내(4일 정도)에 발생하는데, 가슴 통증, 압박감, 불편감, 호흡곤란 또는 숨가쁨, 호흡 시 통증, 심장이 빠르게 뛰거나 두근거림, 실신이 주요 증상이다. 대부분 환자는 일반적인 치료와 휴식 후 빠르게 호전되었고, 정상적인 일상 활동이 가능했다.
2. 아데노바이러스 전달체 백신(아스트라제네카, 얀센)
스코틀랜드인 65세 이상 대상 연구에서 아스트라제네카 1회 접종 시 입원 예방효과는 91.0%(95% CI 75.0-94.0)였다. 국내 초기 분석 결과는 아스트라제네카 1회 접종 시 예방효과 90.8%(95% CI 86.5-93.7)였다[3].
델타형 변이에 대한 아스트라제네카 백신의 효과는 스코틀랜드 연구에서 2차 접종 시 59.8%였다[5]. 이상반응 신고는 약 700만 접종에 1만7천여건으로 0.24%로 보고되고 있다. 이상반응으로는 접종부위 통증, 두통, 피로, 근육통, 권태감, 발열, 오심 등으로 나타났다. 국내에서 수행된 연구에서 발표한 이상반응에서는 ChAdOx1 nCoV-19 백신이 BNT162b2 mRNA COVID-19 보다 국소 및 전신 부작용이 더 많이 보고되었다[7].
전달체 백신에 의한 혈소판감소성혈전증(thrombosis with thrombocytopenia syndrome, TTS)은 발생율이 10만명당 1명 정도로 추정되고, 혈소판 감소를 동반한 뇌정맥동혈전증, 내장정맥혈전증 등이 나타나는 희귀한 혈전증이다. 아데노바이러스 벡터 백신 접종 후 4일~28일 내 발생하는 것으로 알려져 있다. 국외 권고를 참고해 50세 미만은 아스트라제네카 백신 제외 대상이 됐다. 심하거나 2일 이상 지속적인 두통이 발생하며 진통제에 반응하지 않거나 구토를 동반하거나 시야가 흐려지는 경우, 접종 후 4주 이내 호흡곤란, 흉통, 지속적인 복통, 팔다리 부기와 같은 증상이 나타난 경우, 접종 후 접종부위가 아닌 곳에서 멍이나 출혈이 생긴 경우는 혈전 의심증상으로 진료가 필요하다[2].
모세혈관누출증후군(capillary leak syndrome)은 모세혈관에서 체액이 누출되어 팔다리가 붓거나 저혈압을 일으킨다. 유럽의약품청 안전성위원회는 과거 모세혈관누출증후군 병력이 있는 사람은 아스트라제네카, 얀센 백신을 접종하지 않도록 권고했고, 제품 정보에 모세혈관누출증후군을 새로운 이상반응으로 추가하도록 권고하였다[8].
교차접종과 추가접종
캐나다, 스웨덴, 독일, 프랑스, 핀란드, 이탈리아 등 여러 나라에서 백신 수급 문제를 유연하게 대처하고, 아데노바이러스 전달체 백신의 강력한 T-세포 반응 유도와 mRNA 백신의 높은 항체가 형성이라는 각각의 장점을 지닌 교차접종(mix and match or heterologous prime-boost COVID-19 vaccines)에 대한 연구와 실제 접종이 이루어지고 있다. 아직 유효성과 안전성에 대한 충분한 자료가 없지만, 스페인과 독일 연구에서 체액성, 세포성 면역반응의 증가와 중화항체 상승이 보고되었다. 질병관리청은 아래와 같은 교차접종 지침을 발표하고 시행하고 있다[2].
● 질병관리청의 교차접종 지침
2회 접종이 필요한 코로나19 백신의 경우 1, 2차 접종은 동일한 백신으로 완료하는 것이 원칙이다. 그러나 국내에서는 다음의 예외적인 상황에서 한시적으로 1차 접종 백신의 권고 간격에 맞춰 교차접종 가능하다.
ㆍ1차 접종 후 금기대상(아나필락시스 반응, 혈소판감소성혈전증, 모세혈관누출증후군 등)이 된 경우, 반드시 해당 전문의의 진료 및 지도에 따라 서로 다른 플랫폼의 백신으로 2차 접종 고려 가능
ㆍ해외에서 1차 접종한 백신이 국내에서 미승인 되었거나 없는 경우, 사용 가능한 백신으로 2차 접종 진행
ㆍ1차 접종 백신 종류를 모르는 경우, 사용 가능한 백신으로 12주 간격으로 2차 접종 진행
ㆍ1차 접종과 동일 백신이 국내에 없는 경우(공급 불가능), 1차 접종 백신이 연령제한 등으로 접종이 어려운 경우에는 사용 가능한 백신으로 2차 접종 진행
ㆍ의학적 사유로 인해 1차 접종 백신과 다른 백신 접종이 필요하다고 의사가 판단한 경우
현재 이루어지는 교차접종은 1차는 아스트라제네카 백신, 2차를 화이자 백신으로 시행하고 간격은 독일 8주, 스페인 8-12주, 영국 12주였으며 우리나라도 12주를 택하고 있다[6]. 근육통, 오한, 발열 등 일시적인 이상반응은 교차접종에서 조금 더 흔했다는 연구도 있고 차이가 없었다는 연구도 있어 추가 연구가 필요하지만 안전성 문제로 교차접종을 피할 이유는 없다. 얀센 백신은 1차 접종으로 완료이기 때문에 교차접종이라 할 수 없지만, 얀센 백신의 경우도 부스터 접종으로서 mRNA 백신의 추가접종(booster shots)이 이루어지고 있다.
코로나19 기본접종 완료 후 중화항체가는 시간이 경과하면서 감소하며 변이 바이러스를 포함한 코로나19 바이러스에 대한 방어를 연장하기 위해 추가접종이 필요하다. 추가접종은 기본접종 백신 종류와 관계없이 mRNA 백신으로 접종하고, 가급적 동일 백신으로, 접종 백신 종류가 2종을 초과하지 않도록 시행한다. 다만 얀센 백신 기본접종자는 얀센 백신으로 추가접종 가능하다. 기본접종 후 아나필락시스, 혈소판감소증혈전증 등 발생이 확인이 된 금기 대상이거나, 심근염∙심낭염 등 발생으로 접종 연기 대상인 경우, 의사 소견에 따라 기본접종과 다른 플랫폼의 백신으로 추가접종 고려 가능하다[2].
미국 연구에서 화이자, 모더나, 얀센 백신의 기본접종 완료 후 교차접종을 포함한 추가접종 연구에서 모더나, 화이자, 얀센 백신 순으로 중화항체가 높았으나 우리나라에서는 모더나 백신 추가접종을 절반용량(0.25 mL, 50 ug)으로 결정했기 때문에 다른 결과를 보일 수 있다. 이상반응은 얀센 백신 기본접종자의 경우 주사부위 통증과 근육통은 화이자 백신 추가접종에서 더 흔했고, 불편감과 피로감은 모더나 백신 추가접종에서 더 흔했다. 화이자/모더나 백신 기본접종자에서는 화이자 백신 추가접종에서 이상반응이 더 적었으나, 절반용량의 국내 모더나 백신 추가접종에서는 다를 수 있다. (https://pubmed.ncbi.nlm.nih.gov/34671773/) 현재 국내 추가접종은 기본접종 완료자에 한해 6개월이 지난 후 추가접종을 권고하고 있다[2]. 단, 면역저하자, 얀센 백신 접종자 등에게는 필요하다고 판단되는 경우 2개월 이후부터 추가 접종이 가능하다. 50세 이상, 고위험군(감염취약시설 입소자 및 종사자, 병원급 이상 의료기관 종사자 일부 등), 18~49세 기저질환자(당뇨 등 내분비장애, 고혈압 등 심혈관질환, 만성신장질환, 천식 등 만성호흡기질환, 치매 등 신경계질환, 간경변 등 소화기질환), 우선접종 직업군(1차 대응요원, 사회필수인력, 특수교육∙보육, 보건교사 및 어린이집 간호인력, 돌봄종사자, 보건의료인 등)에 대해 기본접종 완료일로부터 6~8개월 사이 추가접종을 권고하고 시행 중이다.
소아청소년에 대한 접종
소아청소년의 감염은 주로 가정, 학교 및 학원 생활 등을 통해 이루어지는데, 16세 이상에서 95%의 효능을 보이고, 무증상 감염도 예방할 수 있다[8,9]. 젊은 층에서의 부작용 빈도가 비교적 높고, 장기적인 안전성이 아직 확립되지 않은 백신을 소아청소년에게 접종하기 위해서는 비용 대비 효과를 철저히 분석해야 하고, mRNA 백신 접종 후 16세 이상 남성 접종자에서 주로 나타나고 있는 심근염에 대한 주의가 필요하다[10].
화이자 백신은 12~15세 국외 임상시험 데이터를 바탕으로 2021년 5월부터 미국, 캐나다, 일본, 유럽 등 일부 국가에서 12세 이상 연령을 대상으로 접종이 허가되었다[9]. 우리나라에서는 7월부터 12세 이상 접종으로 화이자 백신의 허가사항을 변경했고, 10월부터 12세 이상 소아청소년이 접종 대상자에 포함되었다(Table 1)[11]. 소아청소년의 경우는 접종대상 연령이라고 하더라도 코로나19 예방접종에 대한 이익과 위험도를 고려하여 신중하게 접종을 시행하여야 하며, 당사자인 소아청소년 또는 보호자가 접종에 대해서 과도하게 불안해하는 경우에는 무리하게 접종을 시행하지 않는 것이 좋겠다.
COVID-19 기감염자에 대한 접종
COVID-19 기감염자에게 mRNA백신(화이자, 모더나)을 1회 접종한 경우, 항스파이크 단백 항체가가 미감염자보다 10~100배 상승한다는 보고가 있고, 2회 접종 후에도 미감염자에 비해 약 10배 높은 항체가를 획득할 수 있다[12].
코로나19에 대한 면역은 중증도에 따라 차이가 있으며 무증상이나 경증 환자는 중증 환자에 비해 중화항체가가 낮았고, 15% 정도에서는 중화항체가가 충분히 상승하지 않았다는 보고가 있다. 아직 감염과 접종 사이에 얼마나 간격을 두어야 하는지 정해진 바는 없지만, 미국 질병통제센타에서는 감염에서 회복되고 격리 중단 기준을 충족한 후 적당한 시기에 접종을 권고하고 있다. 다만, 무증상이나 경증 환자는 항체가가 충분하지 않을 가능성을 고려해 상대적으로 조기 접종이 필요할 것으로 생각된다. 또한, 코로나-19 감염으로 수동항체 치료(혈장치료나 단일클론항체치료)를 받은 경우는 예방접종으로 인한 면역반응과 항체치료의 간섭효과를 피하기 위해 최소 90일 이후 예방접종 시행을 권고한다[13].
또한 기감염자에서는 미감염자에 비해 접종 후 전신성 부작용 빈도가 화이자 백신에서 2.9배, 아스트라제네카 백신에서 1.6배 높다는 보고가 있으므로, 이에 대한 설명과 주의가 필요할 것으로 생각된다.
임신부와 수유부에 대한 접종
임신부는 코로나 19 이환 시 중증화 위험군에 속하는데, 특히 비만이나 당뇨병 등 동반 질환이 있거나 고령 임신부에서 더 위험하고, 조산이나 태아 사망의 위험도 더 높아진다[14]. 미국에서 임신부 대상 mRNA 백신 예방접종 연구의 예비 결과에 따르면 국소 이상반응 빈도는 조금 더 흔했지만, 발열 등 전신 이상반응은 더 적었고 현재까지 임신부와 태아에게 안전성 문제는 없었다[15]. 이런 연구 결과에 따라 미국 질병통제센타나 일본 산과부인과학회는 각 임신부의 개별화된 감염 위험성과 중증화 위험도, 그리고 백신 접종의 이득을 고려해 접종할 수 있다는 지침이다. 임신 전기간에 접종할 수 있으며 이상반응에 대해 아세트아미노펜 사용이 가능하다고 기재되어 있다[16].
코로나19 예방접종은 불임을 일으킨다는 근거는 없어서, 접종을 위한 임신검사나 예방접종 후 피임은 필요하지 않으며, 임신을 준비하거나 가능성이 있는 경우 임신 전 접종을 권고하고 있다[17]. 1회 접종 후 임신으로 판명된 경우, 2회 접종을 연기할 필요 없이 예정대로 접종하길 권고하고 있다.
수유부 및 모유수유 중인 영유아에 대한 코로나19 백신 안전성과 효능에 대한 자료는 없으나, 접종 대상자일 경우 수유부에게 코로나19 예방접종을 권고하고 있다. 화이자 백신 2차 접종을 한 수유부의 모유에는 빠르면 2주면 IgA 항체, 4주면 IgG 항체가 포함되어 있으며[18]. 모유수유 중인 영유아를 보호하는데 도움이 될 수 있다.
면역저하자에 대한 접종
질병관리청에서는 아직 면역저하자에 대한 코로나19 백신 안전성과 효능에 대한 자료가 없으나, 코로나19 백신은 생백신이 아니므로 접종 대상자일 경우 접종을 권고하고 있다. 다만, 면역저하자의 경우 코로나19 백신의 면역반응이 감소하고 효능에도 영향을 미칠 수 있다는 주의를 주어야 한다[2].
대한류마티스학회는 면역억제제를 포함한 항류마티스약제를 변경할 필요는 없으나 백신의 효과를 높이기 위해서 리톡시맙, 메토트렉세이트, 아바타셉트는 투약 시기를 조절할 수 있다는 가이드라인을 제시했다[19]. 미국류마티스학회에서 제시한 가이드라인에 따르면 하이드록시클로로퀸, 설파살라진, 프레드니솔론 20 mg/일 미만 사용 시에는 이들 약제를 변경하지 않고, 백신 접종도 늦추거나 조정하지 말 것을 권고했다[20]. 장기이식 후 면역억제제 사용하는 환자에 대한 화이자 백신 3차 접종에서 항체 형성은 1차 접종 후 < 5%, 2차 접종 후 40%, 3차 접종 후 80%에서 확인됐고 항체가도 3차 접종 후 더 높았다. 심각한 부작용은 없었으며, 연구 기간 동안 COVID-19도 발생하지 않았다[21]. 이런 결과를 바탕으로 프랑스에서는 면역저하자에게 화이자 백신 3차 접종을 시행하고 있다. 다만, 우리나라의 경우 코로나19 예방접종은 국가예방접종(national immunization program, NIP)의 일환으로 식품의약품안전처의 관리감독과 규제를 받고 있는 상황으로 현 지침에서는 면역억제제를 사용하는 환자의 경우도 정상인과 같은 접종 일정을 따르게 되어 있다.
수술과 예방접종
영국왕립외과대학에서는 응급 수술일 경우 접종과 무관하게 수술 시행을 권고하고 있다. 비응급 정규 수술일 경우 백신 접종 후 바로 가능한데, 발열 등 접종 후 이상반응과 수술 후 염증 등과의 감별을 위해 수일(1주일 정도) 간격을 둘 수 있다고 권고하고 있다[22]. 다만, 이는 백신 이상반응에 초점이 맞춰져 있고 백신 효과나 수술 자체에 대한 영향 측면의 근거나 권고는 아직 없다.
예방접종과 해열제 복용
백신 접종 전, 접종과 함께, 접종 후 증상이 발생하기 전의 해열진통제의 예방적 사용은 현시점에서 전세계적으로 권장하지 않고 있다. 예방적 아세트아미노펜 투여가 백신의 면역원성을 저하시킬 수 있다는 보고가 있기 때문이다[23]. 다만, 접종 후 발열, 전신통증 등 이상반응이 있다면 해열진통제를 사용할 수 있는데[24], 이런 경우 우리나라는 공식적으로 아세트아미노펜을 우선 권고하고 있다[2].
하지만 화이자, 모더나, 아스트라제네카, 얀센 백신의 임상시험 프로토콜을 보면, 접종 후 이상반응에 해열진통제를 사용할 수 있도록 했고 여기에는 NSAIDs(non-steroidal anti-inflammatory drugs)가 포함되어 있었으며 결과적으로 면역원성이나 유효성에 영향을 주지 않았다[7]. 이런 연구 결과에 따라 미국은 모든 허가된 백신 접종 후 이상반응에 대해 아세트아미노펜과 NSAIDs를 적절하게 사용할 것을 권고하고 있다. 일본 역시 2021년 6월 25일부터 아세트아미노펜 뿐만 아니라 NSAIDs도 복용 가능하다는 정보를 추가했다[25]. 기존에 류마티스질환 등에서 해열진통제를 복용 중인 경우 질환이 안정적으로 조절되고 있다면 접종 24시간 전에 중단하고, 대신 접종 후 이상반응 완화를 위한 사용은 가능하다는 것이 전문가 그룹의 의견이다[20].
다른 예방접종과 접종 간격 및 동시접종
우리나라는 이전까지 다른 예방접종과 동시 접종 시 코로나19 백신의 안전성과 유효성 자료는 부족하였기 때문에 단독으로 접종하는 것을 권고하고 다른 예방접종과 접종 전•후 최소 14일 간격 유지를 권고하였으나, 최근 다른 백신과 접종간격에 제한을 두지 않고 있다[2]. 미국에서는 다른 예방접종과 특별한 간격을 두지 않고, 필요한 경우 동시접종도 허용하고 있으며[26], 영국은 잠재적 이상반응을 회피하기 위해 다른 백신과 동시접종은 피하고 최소 1주일 간격을 두는 것을 권하면서도, 꼭 필요한 경우는 조정의 여지를 두고 있다[27].
Discussion
국내 승인된 코로나19 백신의 유효성은 매우 높고, 아나필락시스와 혈소판감소성자반증, 모세혈관누출증후군, 심근염∙심낭염 등 중증 이상반응은 드물지만 심각한 결과를 초래할 수 있으므로 주의가 필요하다. 아직 장기적인 유효성이나 안전성 면에서 불분명한 점은 있지만, 현시점에서 이익이 위험을 상회하는 경우 개인의 감염 예방뿐 아니라 주위 사람에게 감염을 확산시키지 않기 위해서라도 많은 사람이 접종하는 것이 바람직하다. 이때 국가의 접종계획에 따라 적합한 백신을 적절한 방법으로 접종할 필요가 있다.
백신 접종 후 돌파감염과 변이형의 출현으로 COVID-19의 유행이 종식될 때까지 마스크, 손씻기 등의 기본적인 감염 대책과 사회적 거리두기 지침을 적절하게 유지해야 할 것이다.
Notes
Conflict of interest
All authors declare no conflicts-of-interest related to this article.